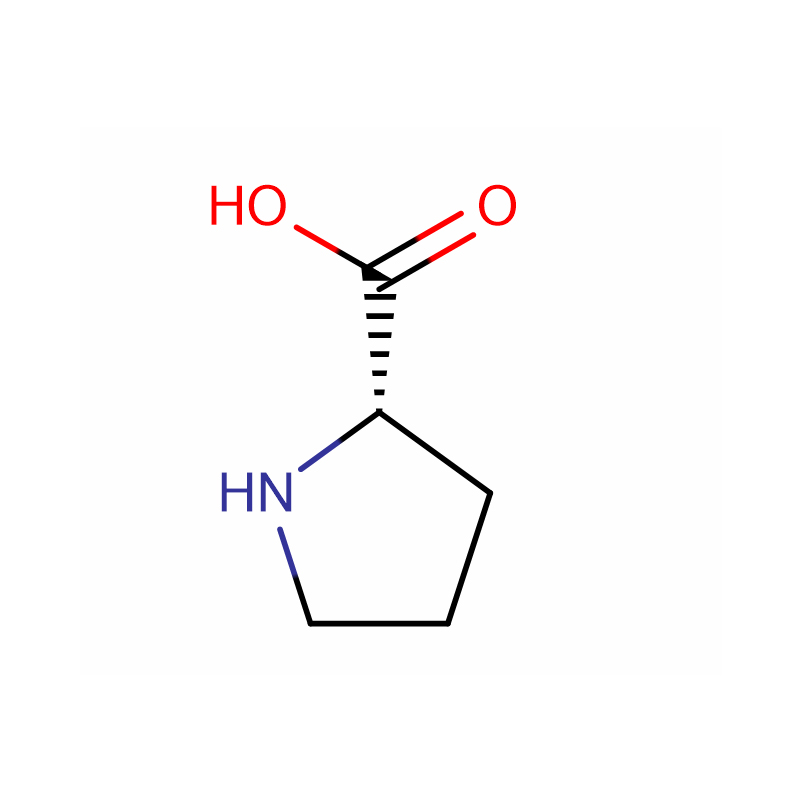
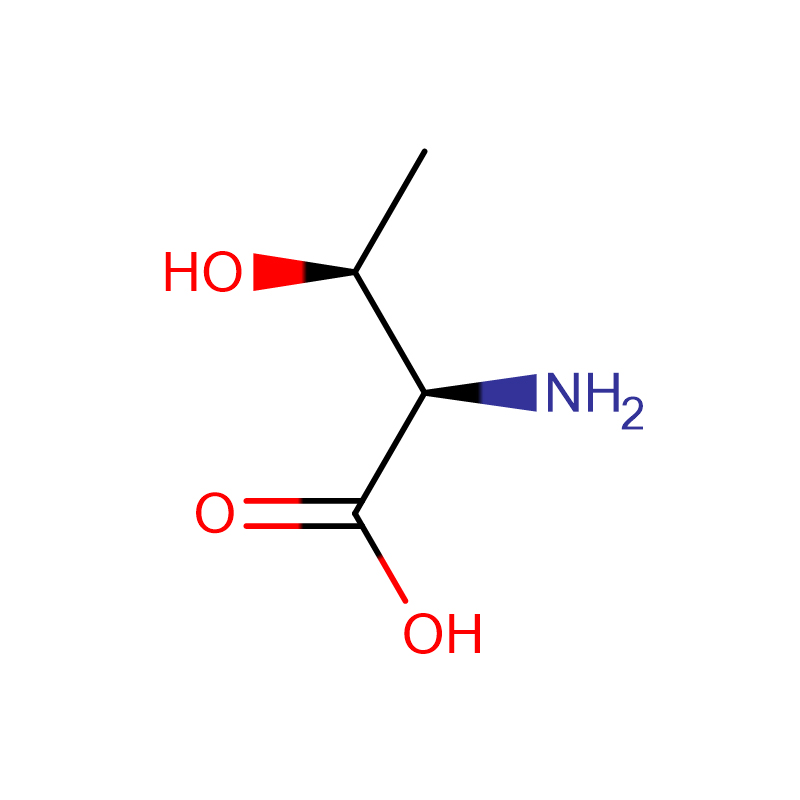
L-Proline Cas: 147-85-3 99% پودر سفید
| شماره کاتالوگ | XD90293 |
| نام محصول | ال-پرولین |
| CAS | 147-85-3 |
| فرمول مولکولی | C5H9NO2 |
| وزن مولکولی | 115.13046 |
| جزئیات ذخیره سازی | محیط |
| کد تعرفه هماهنگ | 29339980 |
مشخصات محصول
| سنجش | 99% دقیقه |
| ظاهر | پودر سفید |
| چرخش ویژه | -84.5 تا -86 |
| فلزات سنگین | <15ppm |
| AS | <1ppm |
| Ph | 5.9 - 6.9 |
| SO4 | <0.050% |
| Fe | <30ppm |
| ضرر در خشک شدن | <0.3% |
| پس مانده های احتراق | <0.10% |
| NH4 | <0.02% |
| Cl | <0.050% |
| وضعیت راه حل | > 98% |
درک متابولیسم میزبان میکروبی برای توسعه و بهینه سازی فرآیندهای بیوکاتالیستی مبتنی بر سلول کامل ضروری است، زیرا کارایی تولید را دیکته می کند.این امر به ویژه برای بیوکاتالیز ردوکس که در آن سلولهای فعال متابولیکی به دلیل ظرفیت احیاکننده کوفاکتور/سوبسترا درونزا در میزبان استفاده میشوند، صادق است.Escherichia coli نوترکیب برای تولید بیش از حد پرولین-4-هیدروکسیلاز (P4H)، یک دی اکسیژناز که هیدروکسیلاسیون L-پرولین آزاد را به ترانس-4-هیدروکسی-L-پرولین با a-ketoglutarate (a-KG) به عنوان سوبسترا کاتالیز می کند، استفاده شد.در این بیوکاتالیست تمام سلولی، متابولیسم کربن مرکزی سوبسترای مورد نیاز a-KG را فراهم میکند و عملکرد بیوکاتالیستی P4H را مستقیماً با متابولیسم کربن و فعالیت متابولیکی جفت میکند.با استفاده از ابزارهای زیست شناسی تجربی و محاسباتی، مانند مهندسی متابولیک و (13) تجزیه و تحلیل شار متابولیک C ((13) C-MFA)، ما پاسخ فیزیولوژیکی، متابولیک و بیوانرژیک بیوکاتالیست کل سلولی را بررسی و به طور کمی توصیف کردیم. به تبدیل زیستی هدفمند و شناسایی تنگناهای متابولیکی احتمالی برای مهندسی مسیر منطقی بیشتر. یک سویه E. coli با کمبود تخریب پرولین با حذف ژن putA که پرولین دهیدروژناز را کد میکند ساخته شد.تبدیل زیستی کل سلولی با این سویه جهش یافته نه تنها به هیدروکسیلاسیون کمی پرولین، بلکه به دو برابر شدن سرعت تشکیل ترانس-4-L-هیدروکسی پرولین (hyp) در مقایسه با نوع وحشی منجر شد.تجزیه و تحلیل شار کربن از طریق متابولیسم مرکزی سویه جهش یافته نشان داد که افزایش تقاضای a-KG برای فعالیت P4H، شار مولد a-KG را افزایش نمی دهد، که نشان دهنده یک عملیات چرخه TCA کاملاً تنظیم شده تحت شرایط مورد مطالعه است.در سویه نوع وحشی، سنتز و کاتالیز P4H باعث کاهش عملکرد زیست توده شد.جالب توجه است، سویه ΔputA علاوه بر این، اتلاف ATP و NADH مرتبط را با کاهش نیازهای انرژی نگهداری در نرخ های جذب گلوکز نسبتا پایین، به جای افزایش فعالیت TCA جبران کرد. برای کاتالیز مولد P4H نه تنها از نظر بازده تبدیل زیستی، بلکه در مورد نرخ تبدیل زیستی و جذب پرولین و بازده هیپ در منبع انرژی نیز امیدوار کننده است.نتایج نشان میدهد که، پس از یک ناک اوت putA، جفت شدن چرخه TCA با هیدروکسیلاسیون پرولین از طریق سوبسترا a-KG به یک عامل کلیدی محدودکننده و هدفی برای بهبود بیشتر کارایی تبدیلهای زیستی وابسته به a-KG تبدیل میشود.