IPTG (ایزوپروپیل-β-D-تیوگالاکتوزید) آنالوگ بستر بتا-گالاکتوزیداز است که بسیار القایی است.تحت القای IPTG، القاء کننده می تواند با پروتئین رپرسور کمپلکسی تشکیل دهد، به طوری که ترکیب پروتئین رپرسور تغییر می کند، به طوری که نمی توان آن را با ژن هدف ترکیب کرد و ژن هدف به طور موثر بیان می شود.بنابراین چگونه باید غلظت IPTG در طول آزمایش تعیین شود؟هر چه بزرگتر بهتر؟
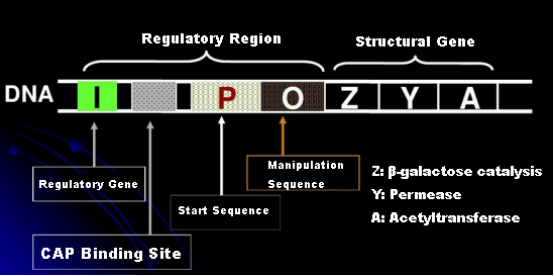
ابتدا، بیایید اصل القای IPTG را درک کنیم: اپرون (عنصر) لاکتوز E. coli شامل سه ژن ساختاری Z،Y، و A است که به ترتیب β-گالاکتوزیداز، پرماز و استیل ترانسفراز را کد می کنند.lacZ لاکتوز را به گلوکز و گالاکتوز یا آلو لاکتوز هیدرولیز می کند.lacY به لاکتوز موجود در محیط اجازه می دهد تا از غشای سلولی عبور کرده و وارد سلول شود.lacA گروه استیل را از استیل-CoA به β-گالاکتوزید منتقل می کند که شامل از بین بردن اثر سمی است.علاوه بر این، یک توالی عامل O، یک توالی شروع P و یک ژن تنظیمی I وجود دارد. کد ژن I یک پروتئین سرکوب کننده است که می تواند به موقعیت O توالی عملگر متصل شود، به طوری که اپرون (متا) سرکوب می شود و خاموش شد.همچنین یک محل اتصال برای محل اتصال پروتئین فعال کننده ژن کاتابولیک-CAP در بالادست توالی آغازگر P وجود دارد. توالی P، توالی O و محل اتصال CAP با هم ناحیه تنظیم کننده اپرون لاک را تشکیل می دهند.ژن های کد کننده سه آنزیم توسط همان ناحیه تنظیم کننده تنظیم می شوند تا به بیان هماهنگ محصولات ژنی دست یابند.
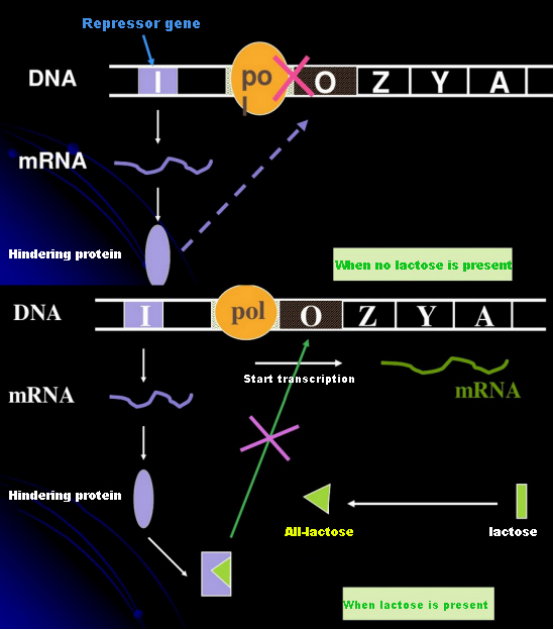
در غیاب لاکتوز، اپرون لاک (متا) در حالت سرکوب قرار دارد.در این زمان، مهارکننده lac که توسط توالی I تحت کنترل توالی پروموتر PI بیان میشود به توالی O متصل میشود، که از اتصال RNA پلیمراز به دنباله P جلوگیری میکند و شروع رونویسی را مهار میکند.هنگامی که لاکتوز وجود دارد، اپرون لاک (متا) می تواند القا شود در این سیستم اپرون (متا)، القا کننده واقعی خود لاکتوز نیست.لاکتوز وارد سلول می شود و توسط β-گالاکتوزیداز کاتالیز می شود تا به آلولاکتوز تبدیل شود.دومی، به عنوان یک مولکول القایی، به پروتئین سرکوبگر متصل می شود و ترکیب پروتئین را تغییر می دهد، که منجر به جدا شدن پروتئین رپرسور از توالی O و رونویسی می شود.ایزوپروپیل تیوگالاکتوزید (IPTG) اثری مشابه آلولاکتوز دارد.این یک القاء کننده بسیار قوی است که توسط باکتری ها متابولیزه نمی شود و بسیار پایدار است، بنابراین به طور گسترده در آزمایشگاه ها استفاده می شود.
چگونه غلظت بهینه IPTG را تعیین کنیم؟E. coli را به عنوان مثال در نظر بگیرید.
سویه مهندسی ژنتیکی E. coli BL21 حاوی pGEX نوترکیب مثبت (CGRP/msCT) در محیط مایع LB حاوی 50μg·mL-1 آمپر تلقیح شد و یک شبه در دمای 37 درجه سانتیگراد کشت داده شد.کشت فوق به 10 بطری 50 میلی لیتری محیط مایع LB تازه حاوی 50 میکروگرم در میلی لیتر-1 آمپر با نسبت 1:100 برای کشت انبساط تلقیح شد و زمانی که مقدار OD600 0.6 تا 0.8 بود، IPTG به غلظت نهایی اضافه شد.0.1، 0.2، 0.3، 0.4، 0.5، 0.6، 0.7، 0.8، 0.9، 1.0mmol·L-1 است.پس از القاء در همان دما و در همان زمان، 1 میلی لیتر از محلول باکتری از آن گرفته شد و سلول های باکتریایی با سانتریفیوژ جمع آوری و تحت SDS-PAGE قرار گرفتند تا تاثیر غلظت های مختلف IPTG بر بیان پروتئین مورد تجزیه و تحلیل قرار گیرد. غلظت IPTG را با بیشترین بیان پروتئین انتخاب کنید.
پس از انجام آزمایشات، مشخص خواهد شد که غلظت IPTG تا حد امکان زیاد نیست.این به این دلیل است که IPTG سمیت خاصی برای باکتری ها دارد.بیش از حد غلظت سلول را نیز از بین می برد.و به طور کلی، ما امیدواریم که هر چه پروتئین محلول بیشتری در سلول بیان شود، بهتر است، اما در بسیاری از موارد زمانی که غلظت IPTG بیش از حد بالا باشد، مقدار زیادی انکلوژن تشکیل می شود.بدن، اما مقدار پروتئین محلول کاهش یافته است.بنابراین، مناسب ترین غلظت IPTG اغلب هر چه بزرگتر باشد بهتر نیست، اما غلظت کمتر است.
هدف از القاء و کشت سویه های دستکاری شده ژنتیکی افزایش عملکرد پروتئین مورد نظر و کاهش هزینه ها می باشد.بیان ژن هدف نه تنها تحت تأثیر عوامل خود سویه و پلاسمید بیان است، بلکه تحت تأثیر سایر شرایط خارجی مانند غلظت القاء کننده، دمای القا و زمان القاء نیز قرار می گیرد.بنابراین، به طور کلی، قبل از بیان و خالص سازی یک پروتئین ناشناخته، بهتر است زمان القاء، دما و غلظت IPTG بررسی شود تا شرایط مناسب انتخاب شود و بهترین نتایج تجربی به دست آید.
زمان ارسال: دسامبر-31-2021

